STICKOXIDE (NOX) IN DER INDUSTRIE
Umwelt- und Klimaschutz ist immer mehr Menschen wichtig. In den zurückliegenden Jahren galt die Aufmerksamkeit dabei vor allem dem als „Klimakiller“ in Verruf geratenen Kohlendioxid sowie dem Feinstaub. Aktuell sind die Stickoxide weltweit Mittelpunkt der öffentlichen Debatte.
Definition Stickoxide
Stickoxide, auch Stickstoffoxide repräsentieren eine Gruppe von chemischen Verbindungen, die aus Stickstoff und Sauerstoff bestehen. Dabei geht es in erster Linie um Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2); die beiden Substanzen werden auch als NOx bezeichnet. Stickstoffmonoxid (NO) ist eine farblose, bioaktive Substanz, die im Körper unter anderem als Botenstoff genutzt wird. Es hat erweiternde Wirkung auf Blutgefäße und wird daher in Kardiologie und Herzchirurgie sowie zur Behandlung von Lungenhochdruck bei Neugeborenen eingesetzt. NO kann in der Atmosphäre leicht zu NO2 oxidiert werden. Stickstoffdioxid (NO2) ist ein rotbraunes, stark giftiges, stechend riechendes Gas, das bei Temperaturen über 200 °C wiederum in Stickstoffmonoxid und Sauerstoff zerfällt. Es bildet mit Wasser Säure und führt zu der Entstehung von sauren Regen; beide Stickoxide tragen außerdem mit zur Entstehung von Sommersmog mit bei. Die Gesundheit von Mensch und Tier wird durch die Substanzen gefährdet. Denn Stickoxide – insbesondere Stickstoffdioxid – reizen und schädigen die Schleimhäute der Atemwege sowie der Augen und beeinträchtigen die Lungenfunktion. Das Einatmen dieser nitrosen Gase in hohen Konzentrationen ist höchst gefährlich; es kann unter anderem eine Atemnot und ein Lungenödem verursachen.
Entstehung der Stickoxide
NOx werden hauptsätzlich durch die Oxidation von Stickstoff während verschiedenen Verbrennungsprozessen gebildet. Man unterscheidet zwischen drei Bildungsmechanismen.
Das sogenannte thermische NOx entsteht bei relativ hohen Temperaturen (über 1300 °C) aus dem Stickstoff und dem Sauerstoff der Verbrennungsluft. Brennstoff-NOx (englisch: fuel-NOx) bildet sich aus im Brennstoff chemisch gebundenem Stickstoff schon ab Temperaturen von 800°C. Diese komplexen chemischen Prozesse können durch die Reaktionsbedingungen stark beeinflusst werden. Dabei ist es unter anderem auch möglich, dass Stickstoff unter der Einwirkung von Brennstoffradikalen (CHx) in der Flammenfront zu Stickoxid, dem sogenannten prompten NOx, umgesetzt wird. Bei normalen Verbrennungsprozessen besteht das NOx zu 95% aus NO, NO2 bildet sich hauptsätzlich im Anschluss der Verbrennung mit dem Sauerstoff der Atmosphäre. Bei ungünstiger Prozessführung aber kann auch Distickstoffmonoxid (N2O) entstehen, besser bekannt als Lachgas. Diese Substanz wird z.B. in der Medizin als Narkosemittel sowie in der Lebensmittelindustrie als Treibgas verwendet. Lachgas gilt vor allem als ein Treibhausgas, deren Auswirkung 298-mal so hoch wie CO2 ist.
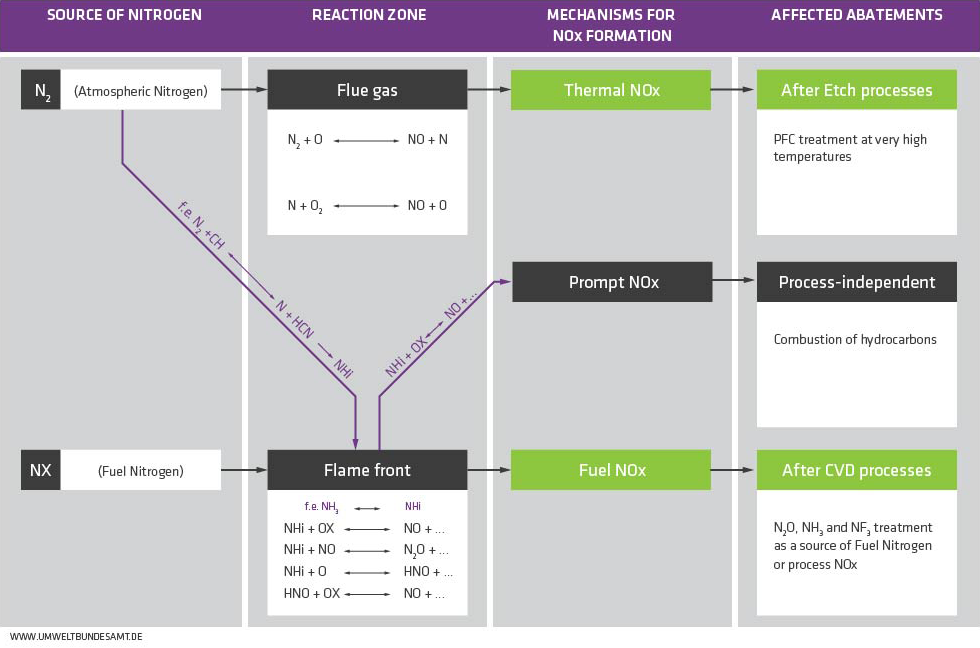
Mechanismen der NOx Bildung in Korrelation mit betroffenen Abatements & Prozessen in Halbleiterindustrie
Stickoxide im Fokus der Umweltpolitik
Aus diesem Grunde gelten für NOx schon heute strenge Grenzwerte in vielen Ländern der Erde. Weltweit bemühen sich Regierungen und Behörden, die Freisetzung dieser Luftschadstoffe weiter einzuschränken. Als eine der Hauptquellen für Stickoxide in der Atmosphäre gelten Abgase, die bei der Verbrennung fossiler Brennstoffe, wie Kohle oder Öl, entstehen. Ein nicht unwesentlicher Anteil dieser Luftverschmutzung wird durch den Verkehr verursacht (ca. 40 % der gesamten Emissionen). Die ortsfesten Verschmutzungsquellen, deren Emissionsanteil ca. 30 % ausmacht sind vor allem Kraftwerke, Abfallverbrennungsanlagen, Glas- und Zementherstellung und Erdölraffinerie. Und nicht nur bei Verbrennungsprozessen, sondern auch beim Arbeiten mit Salpetersäure können Stickoxide freigesetzt werden. Zusätzlich nimmt die Relevanz von der Landwirtschaft als NOx-Emissionsquelle zu (ca. 10%).
Reaktionen aus der Industrie
Generell nimmt die NOx-belastung seit Jahren ab; so war in Deutschland nach Angaben des Umweltbundesamtes von 1990 bis 2016 ein Rückgang der NOx-Emissionen um 58% von 2,892 auf 1,217 Millionen Tonnen zu verzeichnen. Dennoch wird derzeit über eine weitere Verschärfung der Grenzwerte diskutiert, um den Ausstoß von Stickoxiden weiter zu verringern. Beispielhaft werden die von EU in BREF (Beste-Verfügbare-Technik) Referenzdokumenten veröffentlichten Anforderungen an NOx-Emissionen für mit Erdgas befeuerte Großfeuerungsanlagen strenger und sollen bis 2021 unter 30 mg/Nm3 (Tagesmittelwert bei 3% O2) liegen. Der aktuelle Grenzwert (13. BImSchV) beträgt 100 mg/Nm3. Die Industrie beobachtet solche Debatten aufmerksam, und stellt sich darauf ein – denn niedrigere Grenzwerte werden in Zukunft nicht nur beispielsweise die Kraftwerkstechnik, sondern auch Hightech-Branchen wie die Halbleiterindustrie tangieren. Denn selbst in „sauberen“ Industriezweigen werden Stickoxide freigesetzt.
Nm3 … Normkubikmeter, eine Volumeneinheit für Gase mit Bezug auf definierte Umgebungsbedingungen.
Stickoxide aus Reinräumen
Umwelt und Gesundheit zu schützen, ist von Anbeginn ein Anliegen der Hightech-Industrien gewesen. Jedes Unternehmen achtet kontinuierlich darauf, seine Prozesse weiter zu verbessern, sobald dies möglich und notwendig wird. So hat die Branche in jüngster Vergangenheit, unterstützt durch moderne Entsorgungstechnik, beispielsweise die Freisetzung von klimaschädlichen Substanzen beendet. Heute arbeiten die Umweltspezialisten der DAS EE GmbH an Lösungen, die es gestatten, in Zukunft auch die Stickoxide aus den Abgasen der Fabriken zu mindern. Stickstoff wird allgemein als Schutzgas eingesetzt, weil er unter normalen Bedingungen außerordentlich reaktionsträge ist – doch bei hohen Temperaturen kann daraus thermisches NOx entstehen. Wie in der Abbildung 1 dargestellt, betrifft das vor allem solche Point-of-Use Verbrennungsanlagen, welche für die Beseitigung von perfluorierten Kohlenwasserstoffen nach Ätzprozessen eingesetzt werden. Die im Reaktor für die Zersetzung von PFCs erforderlichen Temperaturen begünstigen als Nebeneffekt die NOx-Entstehung. In der Halbleiterindustrie werden Stickstoffverbindungen zudem beispielsweise für das Abscheiden von Nitridschichten benötigt. Für die Bildung von Oxinitridschichten in CVD-Prozessen wird normalerweise Lachgas verwendet. Nicht nur in der Mikroelektronikfertigung, sondern auch bei der Produktion von Dünnschicht-Bildschirmen und Dünnschicht-Solarzellen wird Stickstofftrifluorid (NF3) zum Reinigen von CVD-Kammern eingesetzt, und Ammoniak (NH3) auch bei der Herstellung von kristallinen Silizium-Solarzellen. Die nichtreagierten Reste von erwähnten stickstoffhaltigen Verbindungen werden in der Regel zusammen mit anderen Prozessgasen thermisch entsorgt und gelten dementsprechend als Quelle der Stickoxidemissionen, die nach Brennstoff-NOx Mechanismus entstehen.


Ihr Ansprechpartner zum Thema Stickoxide in der Industrie:
Innovationsmanagement