Effiziente Lösung zur Reduktion von Stickoxid-Emissionen (NOx) in der Halbleiterindustrie
Saurer Regen und starker Smog – diese Bedrohungen für Gesundheit und Natur werden durch NOx (Stickoxide NO2 und NO) verursacht. Der Umgang mit schädlichem NOx, das bei Verbrennungsprozessen entsteht, ist in vielen Branchen eine echte Herausforderung.
DAS Environmental Experts hat eine schlüsselfertige Lösung für die NOx-Behandlung entwickelt, die für die Halbleiterindustrie und andere Branchen geeignet ist.
Was sind Stickoxide und welche Auswirkungen haben sie auf Umwelt und Gesundheit?
Stickoxide, abgekürzt NOx, sind gasförmige Verbindungen, die durch die Verbrennung fossiler Brennstoffe wie Öl, Gas, Kohle oder Holz entstehen. Zur Gruppe der Stickoxide gehören Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2).
Stickstoffmonoxid (NO) ist eine farblose, bioaktive Substanz, die im Körper unter anderem als Botenstoff genutzt wird. Es hat erweiternde Wirkung auf Blutgefäße und wird daher in Kardiologie und Herzchirurgie sowie zur Behandlung von Lungenhochdruck bei Neugeborenen eingesetzt. NO kann in der Atmosphäre leicht zu NO2 oxidiert werden. Stickstoffdioxid (NO2) ist ein rotbraunes, stark giftiges, stechend riechendes Gas, das bei Temperaturen über 200 °C wiederum in Stickstoffmonoxid und Sauerstoff zerfällt. Es bildet mit Wasser Säure und führt zu der Entstehung von saurem Regen; beide Stickoxide tragen außerdem mit zur Entstehung von Sommersmog bei. Die Gesundheit von Mensch und Tier wird durch die Substanzen gefährdet, denn Stickoxide – insbesondere Stickstoffdioxid – reizen und schädigen die Schleimhäute der Atemwege sowie der Augen und beeinträchtigen die Lungenfunktion. Das Einatmen dieser nitrosen Gase in hohen Konzentrationen ist höchst gefährlich; es kann unter anderem Atemnot und Lungenödeme verursachen.
Ein nicht unwesentlicher Anteil der Luftverschmutzung wird durch den Verkehr verursacht (ca. 37 % der gesamten Emissionen). Die ortsfesten Verschmutzungsquellen, deren Emissionsanteil ca. 30 % ausmacht, sind vor allem Kraftwerke, Abfallverbrennungsanlagen, Glas- und Zementherstellung und Erdölraffinerie. Und nicht nur bei Verbrennungsprozessen, sondern auch beim Arbeiten mit Salpetersäure können Stickoxide freigesetzt werden. Zusätzlich nimmt die Relevanz von der Landwirtschaft als NOx-Emissionsquelle zu (ca. 10 %).
Aus diesem Grunde gelten für Stickoxide schon heute strenge Grenzwerte in vielen Ländern der Erde. Weltweit bemühen sich Regierungen und Behörden, die Freisetzung dieser Luftschadstoffe weiter einzuschränken. Nationale Umweltvorschriften wie die TA-Luft Deutschland oder die EPA USA legen strenge Grenzwerte für NOx-Emissionen fest. Deswegen benötigen nicht nur die bereits genannten großen NOx-Emittenten sondern auch High-Tech-Industrien, wie die Halbleiterindustrie, effektive Lösungen zur Vermeidung, Verringerung oder Behandlung von Stickoxiden.
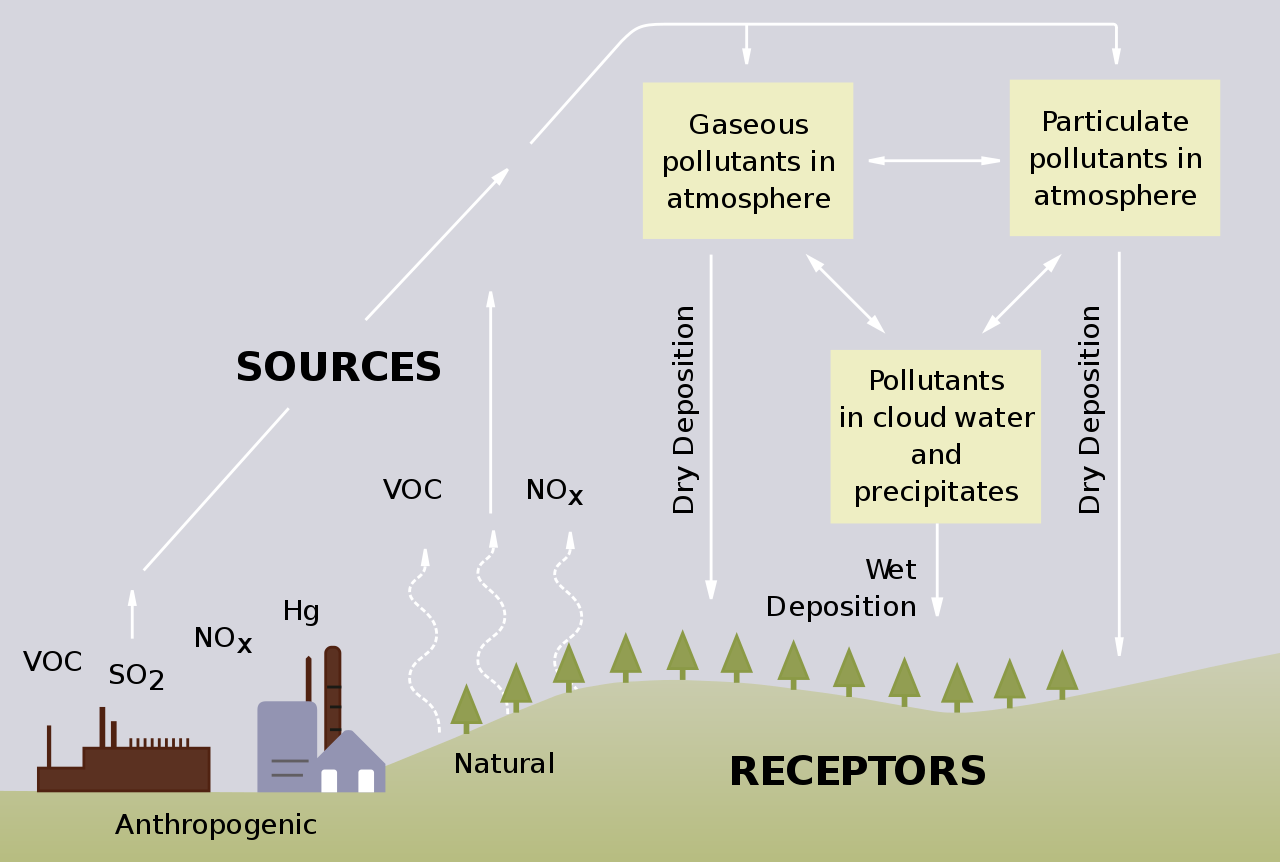
Quelle: https://www.epa.gov/
Wie entstehen Stickoxide?
NOx werden hauptsätzlich durch die Oxidation von Stickstoff während verschiedenen Verbrennungsprozessen gebildet. Es wird zwischen drei Bildungsmechanismen unterschieden. Das sogenannte thermische NOx entsteht bei relativ hohen Temperaturen (über 1300 °C) aus dem Stickstoff und dem Sauerstoff der Verbrennungsluft. Brennstoff-NOx (englisch: fuel-NOx) bildet sich aus im Brennstoff chemisch gebundenem Stickstoff schon ab Temperaturen von 800°C. Diese komplexen chemischen Prozesse können durch die Reaktionsbedingungen stark beeinflusst werden. Dabei ist es unter anderem auch möglich, dass Stickstoff unter der Einwirkung von Brennstoffradikalen (CHx) in der Flammenfront zu Stickoxid, dem sogenannten prompten NOx, umgesetzt wird.
Bei normalen Verbrennungsprozessen besteht das NOx zu 95 % aus NO. NO2 bildet sich hauptsätzlich im Anschluss der Verbrennung mit dem Sauerstoff der Atmosphäre. Bei ungünstiger Prozessführung kann aber auch Distickstoffmonoxid (N2O) entstehen, besser bekannt als Lachgas. Diese Substanz wird z.B. in der Medizin als Narkosemittel, sowie in der Lebensmittelindustrie als Treibgas verwendet. Lachgas gilt vor allem als ein Treibhausgas, dessen Auswirkung 298-mal so hoch wie CO2 ist.

Kontakt
Ihr Ansprechpartner für alle Fragen zum Thema Reduzierung von Stickoxiden in der Halbleiterindustrie
Dr. Christian Kuhne
Director Sales Global
